Koordination:
P. Lind, Klagenfurt
Unter Mitarbeit von:
H. Fritzsche, Feldkirch
A. Kroiss, Wien
W. Langsteger, Graz
P. Lechner, Graz
Ziel
1. Das Hauptziel der Anti-CEA-Immunszintigraphie ist die frühe Erkennung von Lokalrezidiven in der postoperativen Tumornachsorge des kolorektalen Karzinoms. Dabei kann durch die nuklearmedizinische Darstellung der zellulären CEA-Expression ein Lokalrezidiv bereits dann nachgewiesen werden, wenn noch keine typischen morphologischen Veränderungen (CT, MRI) vorliegen. Die Hauptindikation der Anti- CEA-Immunszintigraphie ist daher die Differentialdiagnose zwischen Narbe und frühem lokoregionären Rezidiv.
2. Für die Leberchirurgie kann die Anti-CEA-Immunszintigraphie in Einzelfällen bei bereits morphologisch diagnostizierter singulärer Metastase das Vorliegen von weiteren intrahepatalen CEA-exprimierenden Läsionen nachweisen bzw. ausschließen und so das chirurgische Vorgehen beeinflussen.
3. Der Einsatz der intraoperativen Sondendiagnostik (Szintimetrie) ermöglicht prinzipiell eine exakte Stadienzuordnung zu einem frühen und damit therapeutisch relevanten Zeitpunkt, ist aber auf einzelne Zentren beschränkt.
Tabelle 2: Ergebnisse der Immunszintigraphie in der Diagnostik kolorektaler KarzinomeAutor AK gegen Nuklid Technik n Präv. Sens. Spez.Bares CEA In-111 SP 47 83 38 89Baum CEA Tc-99m SP 20 100 91 87Chetanneau 19.9./CEA In-111 SP 17 94 55 89Bares CEA Tc-99m SP 92 91 67 80Chetanneau 19.9/CEA In-111 SP 92 73 76 88Lamki CEA In-111 SP 16 100 79 100Bischoff-Delaloye CEA J-123 SP 57 81 82 87Lind CEA Tc-99m SP 141 53 91 94
Tabelle 3: Nutzen der Immunszintigraphie in der Diagnostik kolorektaler KarzinomeAutor AK gegen Nuklid n Sens. diagn. ZugewinnBaum 19.9/CEA J-131 70 89 20Riva CEA In-111 70 57 48Becker CEA Tc-99m 37 54 5Chetanneau 19.9/CEA In-111 17 55 41Bares CEA Tc-99m 37 55 8Chetanneau CEA In-111 92 76 19Bischof-Delaloye CEA J-123 57 82 22Lind CEA Tc-99m 141 95 13Barzen CEA Tc-99m 75 64 11
Tabelle 4: HAMA-response nach Einfach- und Mehrfachapplikation undmuriner monoklonaler Antikörper(e = einfach, m = mehrfach)MAK HAMA (%)BW 431/26 (e) 20-30%BW431/26 (m) > 50%Immu 4 Fab’ (e) < 5%Immu 4 Fab’ (m) ?
Einleitung
Die erfolgreiche Anwendung radioaktiv markierter Antikörper in der Diagnose von kolorektalen Karzinomen ist letzlich das Ergebnis einer langen Zusammenarbeit zwischen Immunologie, Radiochemie und Nuklearmedizin.
Der eigentliche Grundstein für eine gezielte immunszintigraphische Darstellung von Tumoren wurde 1965 von Gold and Freedman gelegt, denen die Isolierung des sogenannten carcinoembryonalen Antigens (CEA) aus
Kolonkarzinomzellen gelungen ist.Die Entwicklung von anfangs polyklonalen Antikörper gegen CEA und die Markierung mit Radioisotopen sollte nach intravenöser Injektion dieser Immunkonjugate mittels nuklearmedizinischer Detektionssysteme (Gammakameras), die Lokalisation CEA-exprimierender Tumore ermöglichen.
Die ersten klinisch bedeutenden Untersuchungen mit J-131-markierten polyklonalen Anti-CEA-Antikörpern, kolorektale, CEA-exprimierende Tumore darzustellen gelang Goldenberg 1974.
Klinischen Eingang in die Diagnostik fand die sogenannte Radioimmunszintigraphie (RIS) aber erst durch Weiterentwicklungen auf dem Gebiet der Immunologie, Radiochemie und nuklearmedizinischen Gerätetechnik. Sicherlich die bedeutendste Innovation auf dem Gebiet der Immunologie war die Entwicklung der sogenannten Hybridomtechnik zur Gewinnung monoklonaler Antikörper (MAK) durch Köhler und Millstein,die dafür 1984 den Nobelpreis erhielten. Der enorme Vorteil der monoklonalen Antikörper liegt in ihrer Homogenität und ihrer Spezifität für das entsprechende Antigen. Der entscheidende Impuls von Seiten der Radiochemie erfolgte 1987 durch Schwarz und Steinstraesser, denen eine stabile Markierung monoklonaler AK mit Tc-99m, einem für die Nuklearmedizin optimalen Radionuklid, gelungen ist.
Schießlich war es der zunehmende Einsatz rotierender Gammakamerasysteme und die SPECT-Technik sowie der Einsatz von Mehrkopfkameras, die in letzter Zeit die immunszintigraphische Nachweisbarkeit von kolorektalen Karzinomen, Rezidiven und deren Metastasen deutlich verbessert haben.
Monoklonale Antikörperund Methodik
Strukturell ist jeder MAK aus zwei identischen schweren und zwei leichten Ketten aufgebaut, die jeweils über Disulphidbrücken verbunden sind. Jede Kette wiederum besteht aus einer variablen und einer konstanten Region. Die variable Region ist für die Antigenbindung verantwortlich, die konstante Region für Funktionen wie etwa Komplementbindung oder die antikörperabhängige Zelltoxizität (Abb.1).
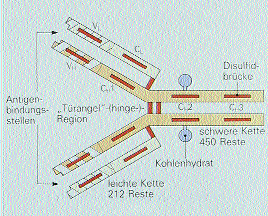
Abb. 1: Struktur monoklonaler Antikörper
Dieser intakte Antikörper kann nun in sogenannte Fab-Fragmente und das Fc-Fragment gespalten werden. Diese Fragmente zeigen im Gegensatz zum intakten MAK eine wesentlich raschere Blutclearance und eine bessere Gewebspenetration.
Für die Anti-CEA-Immunszintigraphie werden heute neben intakten Antikörpern auch Fab’-Fragmente eingesetzt.
Während die meisten in den letzten Jahren für die Immunszintigraphie entwickelten MAK von Mäusen abstammen, gehen immer mehr Bemühungen dahin, den Mausanteil so gering wie möglich zu halten, oder überhaupt durch „genetic engeneering“ humane Designermoleküle herzustellen.Für die Anti-CEA-Immunszintigraphie werden weltweit eine ganze Reihe verschiedenster MAK bzw. MAK-Fragmente mit unterschiedlichen radioaktiven Markierungen verwendet (Tab. 1)
| Tabelle 1: Monoklonale Antikörper (MAK) und deren Markierung (Radionuklid) für die Immunszintigraphie kolorektaler Karzinome | |
| MAK | Radionuklid |
| BW 431/26 | Tc-99m |
| Immu-4 Fab’ | Tc-99m |
| B 72.4 | In-111 |
| 1 A3 | Tc-99m |
| 791T/36 | J-131 |
| 17-1A | J-131 |
| ZCE 025 | In-111 |
| F023C5 | Tc-99m |
| B7-25 5c | J-123 |
Die meisten Erfahrungen bestehen jedoch mit dem auch in Österreich verwendeten MAK-BW 431/26, einem intakten murinen IgG-1 welches mit einem Epitop des CEA (zellgebunden) nicht jedoch mit löslichem CEA reagiert. Dieser MAK ist stabil mit Tc-99m zu markieren (Abb.2).
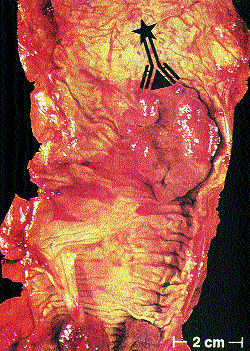
Abb. 2: Schematische Darstellung der Bindung eines Tc-99m markierten
Anti-CEA-MAK an karzinoembryonales Antigen (#: CEA; *: Tc-99m)
Nach Injektion von 1100 MBq Tc-99m MAK BW 431/26 (1 mg AK) werden mittels Gammakamera Ganzkörperaufnahmen 5-6 Stunden p.i. durchgeführt.
Anschließend erfolgen Schichtaufnahmen der interessierenden Region (Becken, Abdomen, Leber) 6 und 24 Stunden p.i.oder 18 Stunden p.i.
Die so erhaltenen Rohdaten werden zu transaxialen, coronalen und sagittalen Schnitten rekonstruiert und beurteilt. In jünster Zeit gelingt es auch aus den rekonstruierten Schnitten 3-D-Bilder herzustellen,was besonders im Beckenbereich für die Lokalisation der dargestellten Läsionen von Vorteil ist.
Primärtumordiagnostik
Die Primärtumorsuche ist nach wie vor der endoskopischen und radiologischen Diagnostik vorbehalten. Die ersten immunszintigraphischen Daten zur Darstellung von kolorektalen Primärtumoren haben zwar eine hohe Sensitivität und Spezifität zum Nachweis CEA-exprimierender Tumore ergeben, führen jedoch zu keiner wesentlichen Zusatzinformation, die über die konventionelle Diagnostik hinausgeht. Außerdem kommt es unter Verwendung von sogenannten murinen monoklonalen Antikörpern zur Möglichkeit der Entwicklung humaner Antimaus-Antikörper (siehe unten), die den später eventuell notwendigen Einsatz der Radioimmunszintigraphie in der kolorektalen Tumornachsorge negativ beinflussen können. Eine sinnvolle jedoch auf Spezialzentren beschränkte Möglichkeit des Einsatzes der Radioimmunszintigraphie in der Primärtumordiagnostik ist die intraoperative Immunszintimetrie.
Dabei wird praeoperativ der radioaktiv markierte monoklonale Antikörper bzw. das Antikörperfragment bei Patienten mit morphologisch bioptisch diagnostiziertem kolorektalem Karzinom intravenös injiziert und die Operation spätestens 24 Stunden p.i. begonnen.
Mittels einer mit Kollimator versehenen stabförmigen Gammasonde (Caesium-Jodidkristall), welche von einem sterilen Plastikschlauch überzogen ist, werden alle sicher oder möglicherweise tumorösen Areale beginnend am Primärtumor vermessen.
Anschließend erfolgt das Lymphknotenstaging, wobei Vergleichsmessungen zwischen Lymphknoten, die für den Tumor regionär sind und solchen, die einem sicher krebsfreien Darmabschnitt zuzuordnen sind, durchgeführt werden.
Die intraoperative Szintimetrie erlaubt daher in erfahrenen Händen eine Lokalisation metastatischer Absiedelungen sowie eine exakte Stadienzuordnung zu einem frühen und therapeutisch relevanten Zeitpunkt.
Rezidivdiagnostik
Die Hauptindikation zur Durchführung der Anti-CEA-RIS in der postoperativen Tumornachsorge liegt in der Fragestellung Narbe – Rezidiv. Insbesondere bei Patienten mit Zustand nach Rektumamputation kommt es in der Praesakralregion häufig zu narbigen Veränderungen, wobei es mit morphologischen Methoden wie CT und MRI nicht möglich ist, ein frühes malignes Rezidiv auszuschließen. Dazu kommt, daß gerade beim frühen lokoregionären Rezidiv der Serumtumormarker CEA häufig negativ bleibt. Da die Anti-CEA-RIS die zelluläre Expression des CEA bildlich zur Dastellung bringt, ist es mit dieser Methode möglich, lokoregionäre Frührezidive auch bei normalem Serum-CEA-Spiegel darzustellen.
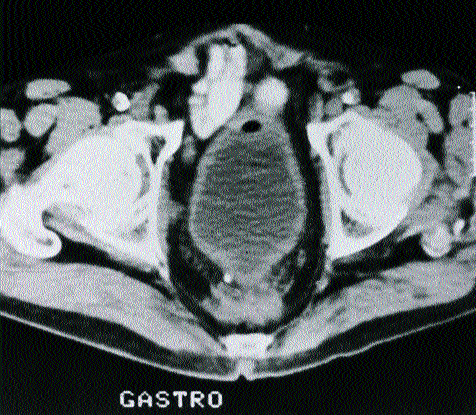
Abb. 3a: TCT des Beckens bei Zustand nach Rektumamputation: praesakrale hyperdense Läsion (als Narbe beurteilt).
Abb. 3 zeigt einen transversalen TCT-Schnitt (a) und einen transaxialen SPECT-Schnitt (b) bei einem Patienten mit Zustand nach Rektumamputation. In der postoperativen Tumornachsorge ergab der Serum-CEA-Spiegel mit 0,56 ng/ml einen negativen Wert bzw. auch im intraindividuellen Verlauf keinen Anstieg als Hinweis auf ein malignes Rezidiv. Die Beurteilung des Computertomogramms sprach ebenfalls für das Vorliegen einer Narbe in der Praesakralregion.
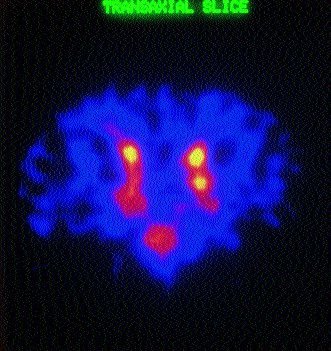
Abb. 3b: Anti-CEA-SPECT desselben Patienten: die deutliche Tc-99m MAK-Anreicherung spricht für ein frühes kolorektales Rezidiv und gegen eine Narbe (operativ histologisch verifiziertes malignes praesakrales Rezidiv).
Die anschließend durchgeführte Anti-CEA-RIS zeigt jedoch eine eindeutige herdförmige Anreicherung des monoklonalen Anti-CEA-Antikörpers in der Praesakralregion.
Die Operation und histologische Aufarbeitung bestätigte den immunszintigraphischen Verdacht auf das Vorliegen eines frühen lokoregionären Rezidivs.
Entscheidend für die Darstellung kleinster früher kolorektaler Rezidive ist eine exakte Patientenvorbereitung und Durchführung der radioimmunszintigraphischen Untersuchung.
Dies inkludiert eine Harnkatheterisierung vor der immunszintigraphischen SPECT-Aufnahme, da der Antikörper bzw. die Antikörperfragmente über die Nieren in die Harnblase ausgeschieden werden und durch die postoperativ narbige Verziehung der Harnblase zu falsch positiven Ergebnisse führen kann. Zusätzlich ist es notwendig, die Untersuchung mit modernsten hochauflösenden Gamma-Kameraköpfen, nach Möglichkeit mit einer Doppelkopfkamera durchzuführen.
Neben der heute üblichen SPECT-Technik (Schichtaufnahme) bringt die 3-D-Rekonstruktion eine deutliche Verbesserung der Darstellbarkeit kleiner Rezidive. (Abb. 4)
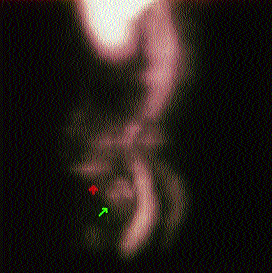
Abb. 4: Anti-CEA 3D-Rekonstruktion des Beckens: Deutliche MAK Anreicherung in der Praesacralregion als Zeichen eines lokoregionären Rezidivs.
Falsch negative Ergebnisse resultieren vor allem durch eine fehlende CEA-Expression im Lokalrezidiv bzw. durch einen zu geringen Antikörperuptake im Tumor. Falsch positive Ergebnisse können durch eine unspezifische Antikörperausscheidung in den Darm (insbesondere Colon ascendens), durch eine falsch positive Bewertung einer Harnaktivität bei nach dorsal verzogener Harnblase sowie durch eine falsch interpretierte Gefäßaktivität bedingt sein.
Tab. 2 und 3 geben eine Übersicht über die Ergebnisse der Radioimmunszintigraphie in der Diagnostik kolorektaler Karzinome mit unterschiedlichen Antikörpern und Radionuclidmarkierungen; außerdem ist der Zugewinn durch die RIS im Vergleich zu anderen Methoden in Prozent der Gesamtuntersuchungen dargestellt.
Aus heutiger Sicht stellt die Radioimmunszintigraphie in der Tumornachsorge kolorektaler Karzinome keine zu fixen Zeitpunkten durchzuführende Routinemethode dar, sondern sollte auf Problempatienten beschränkt sein, bei denen klinisch der Verdacht auf ein Lokalrezidiv besteht, die morphologische Diagnostik und die Nachsorge mittels Tumormarker jedoch dieses nicht verifizieren kann. Von besonderer Bedeutung ist die Anti-CEA-RIS für die prognostischen Gruppe 3 und 4 nach Hermanek bzw. ab Dukes C1.
Metastasendiagnostik
Da die kurative Resektion von Lebermetastasen kolorektaler Karzinome in den letzten Jahren zunehmend an Bedeutung gewinnt, stellt sich die Frage, ob mit der Anti-CEA-RIS bereits frühe CEA-exprimierende Läsionen dargestellt werden können ohne daß diese bereits zu morphologischen Veränderungen führen. In diesem Zusammenhang ist es von Bedeutung, daß bei morphologisch (CT, Sono) diagnostizierten singulären Metastasen weitere CEA-exprimierende Läsionen vor einem chirurgischen Eingriff ausgeschlossen werden können. Prinzipiell sollte die Anti-CEA-RIS dazu geeignet sein. (Abb. 5)
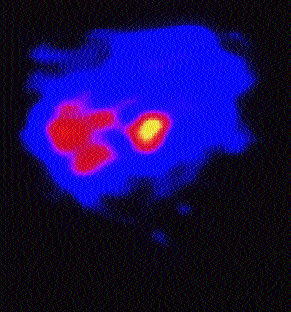
Abb. 5: Anti-CEA-SPECT (coronaler Schnitt): Neben der positiven Speicherung im li. Leberlappen (morph. bekannte „singuläre“ Metastase bei kolorektalem Karzinom) kommt es zu einer fleckenförmig pathologischen Anreicherung im rechten Leberlappen als Zeichen zusätzlich CEA-exprimierender Läsionen in diesem Bereich.
Das Problem der RIS mit intakten monoklonalen Antikörpern ist jedoch die zumindest initial relativ hohe unspezifische Anreicherung in der Leber und die oft nur geringe zelluläre CEA-Expression von Metastasen im Gegensatz zum Primärtumor.
Da die unspezifische Anreicherung 24 Stunden p.i. jedoch deutlich geringer ist als in der Frühaufnahme 6 Stunden p.i. sollte die immunszintigraphische Untersuchung der Leber ausschließlich als Spätaufnahme 24 Stunden p.i. durchgeführt werden.Auch bei der Diagnostik CEA-exprimierender Lebermetastasen kann die 3-D-Rekonstruktion zusätzliche Information zu den einzelnen Schnittbildern insbesondere im Hinblick auf die Lokalisation bzw. Abgrenzung zu vasculären Strukturen bieten. (Abb. 6)
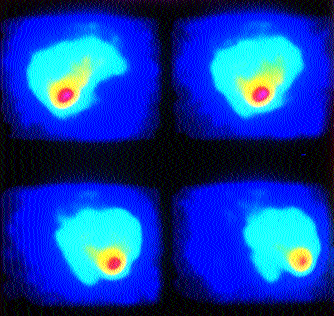
Abb. 6: Anti-CEA-SPECT (3D-Rekonstruktion): Erhöhter Serum-CEA-Spiegel (37,2 ng/ml) bei Zust. nach Hemicolectomie re. Bei unauffälliger Morphologie zeigt der Anti-CEA-SPECT (bzw. 3D-Rekonstruktion) eine eindeutig pathologische Speicherung caudal lateral im rechten Leberlappen als Zeichen einer CEA-exprimierenden Metastase.
Obwohl durch die unspezifische Leberspeicherung die Sensitivität und Spezifität der Anti-CEA-RIS für die Darstellung von Lebermetastasen deutlich geringer ist als für die Darstellung von lokoregionären Rezidiven, sollte in Einzelfällen praeoperativ der Ausschluß bzw. Nachweis zusätzlicher CEA-exprimierender Läsionen immunszinti-graphisch durchgeführt werden.
In Einzelfällen ist die Anti-CEA-RIS auch in der Lage, CEA-exprimierende Metastasen kolorektaler Karzinome in anderen Organen darzustellen (Abb.7).

Abb. 7: Anti-CEA-SPECT (coronaler Schnitt): Mehrere Areale mit Mehrspeicherung als Zeichen CEA-exprimierender Hirnmetastasen.
Humane Antimaus-Antikörper (HAMA)
Da es sich bei den derzeit in Verwendung befindlichen monoklonalen Antikörpern zur Darstellung CEA-exprimierender Tumore nach wie vor um Maus-Antikörper handelt, ist vor allem bei Wiederholungsuntersuchungen mit der Entwicklung sogenannter humaner Antimaus-Antikörper (HAMA) zu rechnen.
Abhängig von der Immunogenität des monoklonalen Antikörpers und der Menge des injizierten Antikörpers liegt der HAMA-Response nach Erstapplikation zwischen 5 und 30 %, kann jedoch bei Wiederholungsuntersuchungen bis über 50 % ansteigen (Tab. 4).
Humane Antimaus-Antikörper können sich entweder gegen den Fc-Anteil (antiisotypisch) oder gegen den Fab-Anteil (antiidiotypisch) richten. Vor allem bei Überwiegen der antiidiotypischen Antikörper ist neben der unspezifisch erhöhten Antikörper-Komplexspeicherung im RES von Leber, Milz und Knochenmark damit zu rechnen,daß die nachzuweisende antigene Struktur des Tumors bzw. Rezidivs oder der Metastasen vom Antikörper nicht mehr in ausreichendem Maß dargestellt wird und daraus falsch negative Befunde resultieren.
Vor allem die Möglichkeit der Entwikklung humaner Antimaus-Antikörper hat dazu geführt, daß die Anti-CEA-RIS nicht als routinemäßige Nachsorgeuntersuchung beim kolorektalen Karzinom klinischen Eingang gefunden hat und daher nur für spezielle Fragestellungen in der Rezidivdiagnostik und Metastasensuche empfohlen werden kann.
Zusammenfassung
Mit der Entwicklung monoklonaler Antiköper gegen carcinoembryonales Antigen, deren Markierung mit Tc-99m und unter Verwendung modernster hochauflösender Gammakamerasysteme ist die Radioimmunszintigraphie nicht nur für wissenschaftliche Fragestellungen sondern als klinisch relevante additive nuklearmedizinische Methode zu den konventionellen morphologischen Methoden einsetzbar. Die Hauptindikation für die Durchführung der Anti-CEA-RIS liegt in der Früherkennung des lokoregionären kolorektalen Rezidivs bei dem sowohl die morphologischen Methoden als auch der Tumormarker CEA falsch negativ sein können. In Einzelfällen ist der immunszintigraphische Nachweis bzw. Ausschluß zusätzlicher morphologisch noch nicht erfaßbarer CEA-exprimierender Leberherde vor der Metastasenchirurgie von Bedeutung.Aus heutiger Sicht sollte die Radioimmunszintigraphie vor allem durch die mögliche Entwicklung humaner Antimaus-Antikörper nicht routinemäßig eingesetzt werden, sondern auf spezielle Fragestellungen beschränkt bleiben. In Zentren mit enger Zusammenarbeit zwischen Chirurgie und Nuklearmedizin erlaubt die Immunszintimetrie mit intraoperativ eingesetzten Gammasonden die exakte Stadienzuordnung zu einem frühen und therapeutisch relevanten Zeitpunkt.
