Koordination:
M. Klimpfinger, Graz
Unter Mitarbeit von:
G. Mikuz, Innsbruck
A. Reiner, Wien
Ziel
Das wesentlichste Ziel der pathologischen Klassifikation von Kolonkarzinomen ist es, zu einer differenzierten histologie- und stadiengerechten Tumortherapie beizutragen. Dabei erfolgt die Diagnostik und Therapie von Kolonkarzinomen heute in multidisziplinärer Kooperation von Gastroenterologen, Radiologen, Pathologen, Chirurgen und internistischen Onkologen. Es ist daher in diesem Zusammenhang hervorzuheben, daß ein klinisch orientierter Pathologe in dieses Team eingegliedert werden muß. Dies ist im Rahmen der modernen multimodalen Tumortherapie auch im Hinblick auf die interdisziplinäre Qualitätssicherung im Sinne des Patienten unerläßlich.
Inzidenz und Ätiologie
Die Inzidenz des kolorektalen Karzinoms ist in den westlichen Industrieländern allgemein hoch, wobei vor allem das Kolonkarzinom die insgesamt steigende Inzidenz verursacht. Das Rektumkarzinom zeigt derzeit eine geringfügig abnehmende Inzidenz. Die Ätiologie des Dickdarmkarzinoms ist multifaktoriell, wobei Ernährungsfaktoren wie reichliche Zufuhr von Fett und tierischem Eiweiß mit insgesamt ballaststoffarmer Kost heute allgemein als Risikofaktor angesehen werden. Dem Ernährungsfaktor wird eine wesentliche Rolle für die sog. sporadischen Kolonkarzinome (ca. 90%) zugeschrieben. Weniger als 10% der Kolonkarzinome sind auf primäre genetische Defekte zurückzuführen. Hierbei steht vor allem das hereditäre, nicht polypöse Kolonkarzinom (HNPCC= Lynch-Syndrome I und II) im Vordergrund mit ca. 5-7%. Die familiäre adenomatöse Polypose (FAP) spielt mit weit unter 1% eine relativ geringere praktische Rolle.
Lokalisation und Makroskopie
Eine strikte Unterscheidung von Kolon- und Rektumkarzinomen ist vor allem in Hinsicht auf die chirurgische Operabilität (wesentlich niedrigere Lokalrezidivraten beim Kolonkarzinom), für die Art der adjuvanten Tumortherapie (beim Kolonkarzinom v. a. Chemotherapie) und die Prognosebeurteilung (durchschnittlich beim Kolonkarzinom besser als beim Rektumkarzinom, vor allem bezogen auf die fortgeschrittenen Tumorstadien) essentiell. Die Kenntnis der unterschiedlichen makroskopischen Wuchsformen von Kolonkarzinomen ist vor allem für die gezielte Entnahme von repräsentativem Biopsiematerial außerordentlich wichtig. Sie erlaubt außerdem eine grobe Vorbeurteilung der Prognose. Polypoide und plateauartige Tumoren metastasieren durchschnittlich seltener als die diffus infiltrierenden. Die Mehrzahl der Tumoren ist zentral ulzeriert mit wallartigen Rändern.
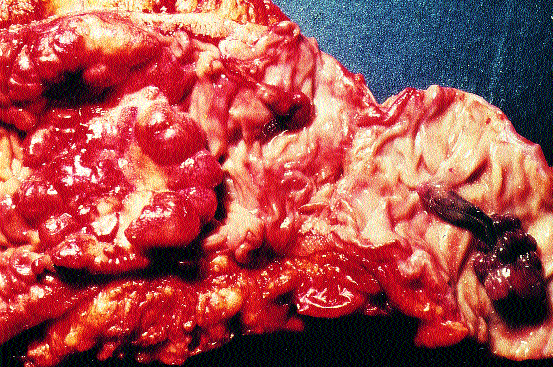
Abb. 1: Chirurgisches Hemikolektomiepräparat mit fortgeschrittenem zentral ulzeriertem Kolonkarzinom sowie gestielten Polypen
Histologische Tumorklassifikation
Das Adenokarzinom ist mit 80-85% der häufigste maligne Tumor des Kolons, das muzinöse Adenokarzinom mit 10-15% folgt mit deutlichem Abstand. Siegelringzellkarzinome und undifferenzierte Karzinome sind mit ca. 2-3% eher seltene, aber hoch agressive Tumore. Andere Karzinomtypen sind Raritäten und spielen praktisch so gut wie keine Rolle.
Tumorgrading
Die WHO unterscheidet nach der histologischen Ähnlichkeit des Karzinoms zum Ausgangsgewebe drei verschiedene Differenzierungsgrade, wobei die hoch- und mitteldifferenzierten Adenokarzinome als solche mit niedrigem Malignitätsgrad den niedrig differenzierten als solchen mit hohem Malignitätsgrad gegenübergestellt werden. Dem hohen Differenzierungsgrad der WHO entspricht analog die Bezeichnung G-1 der UICC, dem mitteldifferenzierten G-2 und dem niedrigdifferenzierten G-3. Der zusätzlich in der UICC vorgesehene Differenzierungsgrad G-4 entspricht dem eigenen histologischen Tumortyp des undifferenzierten Karzinoms der WHO-Nomenklatur. Dem histopathologischen Grading kommt praktische Bedeutung zu, da nur Karzinome vom niedrigen Malignitätsgrad für lokale Therapieverfahren (endoskopische Polypektomie, chirurgische Lokalexzisionen) geeignet sind. Kolonkarzinome von hohem Malignitätsgrad sind aufgrund statistisch signifikant höherer Lymphknotenmetastasierungsraten für lokale Abtragungsverfahren nicht geeignet. Aus onkologischer Sicht ebenfalls nicht für lokale Abtragungsverfahren geeignet sind Fälle, bei denen die Tumorinfiltration die Resektionsfläche erreicht oder histologisch nachweisbare Lymphgefäß- oder Veneneinbrüche vorliegen.
| Tabelle 1: Stadiengruppierungen | ||||
| Stadium 0 | Tis | NO | MO | |
| Stadium I | T1 | NO | MO | Dukes A |
| T2 | NO | MO | ||
| Stadium II | T3 | NO | MO |
Dukes B |
| T4 | NO | MO | ||
| Stadium III | jedes T | N1 | MO | |
| Dukes C* | ||||
| jedes T | N2, N3 | MO | ||
| Stadium IV | jedes T | jedes N | M1 | |
| * Dukes B setzt sich zusammen aus einer Gruppe mit besserer (T3 N0 M0) und schlechterer (T4 N0 M0) Prognose, ebenso Dukes C (jedes T N1 M0 und jedes T N2, 3 M0) | ||||
Tumorstaging
Für das Tumorstaging ist heute die parallele Durchführung der Residualtumorklassifikation und der Tumorstadienermittlung nach dem TNM-System der UICC als unerläßlicher Standard anzusehen.
Die Residual (R)-Klassifikation der UICC gibt Auskunft über das Fehlen oder Vorhandensein von nachweisbarem Residualtumor (Resttumor) nach erfolgter Therapie und wird mit dem Symbol „R” beschrieben. R-0 bedeutet „kein nachweisbarer Residualtumor”, während R-1 einen mikroskopisch und R-2 einen makroskopisch nachweisbaren Residualtumor kennzeichnen. Nach den Regeln der UICC gelten daher sowohl ein lokoregionärer Tumor als auch nicht resezierbare Fernmetastasen als Residualtumor. Die Residualtumorklassifikation soll beim Kolonkarzinom in jedem Fall durchgeführt werden, da primär palliative Eingriffe (R1-, R2-Resektionen) von potentiell kurativen (R0-Resektionen) unterschieden werden können. Dabei ist hervorzuheben, daß nur dann eine Rl-Resektion vorliegt, wenn eine chirurgische Resektionslinie durch lichtmikroskopisch intaktes Tumorgewebe verläuft. Die Residualtumorklassifikation ist prognostisch statistisch höchst signifikant. Darüber hinaus ist die exakte Residualtumorklassifikation eine entscheidende Ausgangsbasis für die adjuvante Tumortherapie. Es ist hervorzuheben, daß die Residualtumorklassifikation nur in enger klinisch-pathologischer Zusammenarbeit durchgeführt werden kann. Seitens des Pathologen müssen bezüglich der Residualtumorklassifikation nicht nur der aborale und orale chirurgische Resektionsrand sondern auch die sog. laterale (=tiefe mesenteriale) chirurgische Resektionsfläche im Mesenteriumbereich histologisch untersucht werden. Die laterale chirurgische Resektionsfläche soll vom Chirurgen mittels Farbstoff (v.a. Tusche) oder mittels Fäden markiert werden.
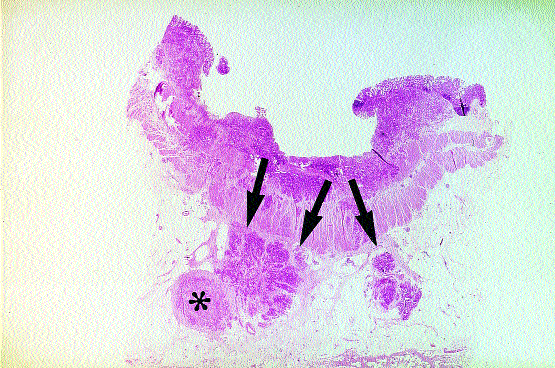
Abb. 2: Histologischer Großflächenschnitt (H. E.-Färbung; Querschnitt) durch ein invasives, ulzeriertes Adenokarzinom des Kolons mit Durchbruch durch die Darmwnd in das mesenteriale Fettgewebe (Pfeile) mit regionärer Lymphknotenmetastase (*)
Tumorstadien 0-IV nach UICC
Der Ermittlung der Tumorstadien 0-IV nach UICC kommt wesentliche prognostische aber auch therapeutische Weichenstellung beim Kolonkarzinom zu. Vor allem bei den R-0 resezierten Fällen lassen sich auf der Basis des TNM-Systems statistisch signifikante und prognostisch relevante Tumorstadien ermitteln. Das Tumorstadium wird dabei aus der Kombination der jeweiligen T-, N- und M-Kategorie ermittelt. Den klinischen T-, N- und M-Kategorien entsprechen die jeweiligen pathologischen Kategorien, die mit p als pT, pN oder pM zu kennzeichnen sind. Die T-Kategorie bezeichnet jeweils die tiefste Tumorinfiltration des vorliegenden Primärtumors, die N-Kategorie die Tumorausbreitung im Bereich der regionären Lymphabflußgebiete und die M-Kategorie das Fehlen oder Vorhandensein von Fernmetastasen (siehe Tabelle 1). Seitens des Pathologen ist bei der Präparataufarbeitung neben der exakten Bestimmung der Primärtumorausdehnung und der Untersuchung der Resektionsflächen auf eine repräsentative Anzahl histologisch untersuchter Lymphknoten zu achten. Für standardisierte Radikaleingriffe am Kolon sollte die Zahl durchschnittlich untersuchter und histologisch verifizierter Lymphknoten bei gutem klinisch-pathologischem Standard über 20 pro Resektat liegen. Für eine repräsentative Beurteilung der Tumorausbreitung im Bereich der Lymphknoten ist heute international eine Mindestzahl von 12 Lymphknoten gefordert. Bei der Auswertung größerer Fallzahlen soll die Zahl der Fälle, in denen mehr als 12 Lymphknoten histologisch verifiziert wurden, zumindest 95% ausmachen. Darunterliegende Lymphknotenzahlen bzw. Prozentsätze können unter Berücksichtigung heutiger Qualitätsstandards nicht mehr als ausreichend angesehen werden.
Die Dukes-Klassifikation (Originalversion) kann zusätzlich zur TNM-Klassifikation eingesetzt werden. Es ist jedoch festzuhalten, daß es sich ausschließlich um eine Klassifikation von Operationspräparaten handelt, die modernen multimodalen Therapiekonzepten nicht mehr gerecht wird. Dabei fehlen die Beurteilung der Radikalität des chirurgischen Eingriffs ebenso wie die Berücksichtigung wichtiger adjuvanter Tumortherapieverfahren wie Chemo- und Strahlentherapie. Im Gegensatz dazu sind die Eckpfeiler der Dukes-Klassifikation wie Tiefeninfiltration der Darmwand durch den Primärtumor und Lymphknotenstatus sehr wohl im TNM-System der UICC berücksichtigt.
Abb. 3: Querschnitt durch ein subtotal stenosierendes Kolonkarzinom (Pfeil) mit gleichzeitig tiefer Infiltration des mesenterialen Fettgewebes (*); klinisch lleus/subtotale Kolektomie.

Abb. 3a: makroskopischer Querschnitt
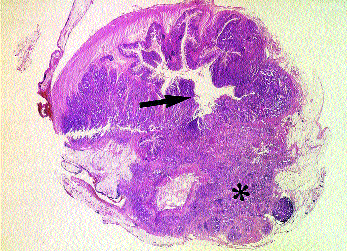
Abb. 3b: korrespondierender histologischer Großflächenschnitt (H. E.-Färbung)
Richtlinien für die Behandlung von Operationspräparaten
Im Idealfall soll das Operationspräparat im nicht eröffneten Zustand auf raschem Weg dem Pathologen übergeben werden. Dabei sollten die Ligaturen der großen Gefäßstämme ebenso fadenmarkiert werden, wie suspekte Stellen im Bereich von Resektionsflächen (fragliche Unradikalität). Bei längerer Transportdauer sind Kolonresektate entlang der Taenia libera zu eröffnen, der Darminhalt auszuspülen und das Präparat auf einer Korkplatte ausgespannt mit ausreichend Formalin (10%iger Formaldehyd) zu fixieren (Formalinmenge im Verhältnis zur „Gewebsmenge” ca. 10 : 1).Ein intraoperativer Schnellschnitt ist nur dann indiziert, wenn von der Schnellschnittdiagnose eine Änderung des operationstaktischen Vorgehens abhängt (z.B Untersuchung einer nicht sicher tumorfreien chirurgischen Resektionsfläche oder auf Tumorinfiltration suspekte überregionäre Lymphknoten).
Anhang
Präkanzeröse Bedingungen und Läsionen
Präkanzeröse Bedingungen weisen ein erhöhtes Entartungsrisiko auf und haben vor allem für die Krebsvorsorge Bedeutung, während den präkanzerösen Läsionen diagnostische Konsequenzen zukommen. Dabei ist vor allem zu klären, ob es sich nur um eine präkanzeröse Läsion handelt oder ob nicht in dieser bereits ein Karzinom entwickelt ist.
Präkanzeröse Bedingungen:
Anamnese
- früher entferntes kolorektales Karzinom
- früher entferntes kolorektales Adenom
- Familiäre Häufung inkl. des HPNCC (=Lynch-Syndrome I u. II )
- Ureterosigmoideostomie
Colitis ulcerosa
Das Entartungsrisiko ist v.a. erhöht bei Erstmanifestation im jugendlichen oder jungen Erwachsenenalter, bei diffusem Befall im Sinne einer Panproktokolitis mit häufigen akuten entzündlichen Schüben. In diesem Fall liegt das Entartungsrisiko nach 10-20 Jahren Erkrankungsdauer ca. 20-30fach höher als in der Normalbevölkerung. Die auf das linksseitige (distale) Kolorektum beschränkte Colitis ulcerosa mit einer durchschnittlichen Erstmanifestation im mittleren Lebensalter hat dem gegenüber ein geringeres Entartungsrisiko, das nach 10-20 Jahren Erkrankungsdauer bei ca. 5-10fach gegenüber der Normalbevölkerung erhöht ist.
Sonstige
- Morbus Crohn (2-4fach erhöhtes Karzinomrisiko verglichen mit der Normalbevölkerung – durchschnittlich niedriger als bei Colitis ulcerosa)
- Schistosomiasis intestinalis
- Strahlenkolitis
- juvenile Polypose

Abb. 4: Leberressektat mit solitärer Lebermetastase einer Kolonkarzinoms
Präkanzeröse Läsionen (Dysplasien)
Dysplasien sind definiert als zweifelsfreie neoplastische Epithelveränderungen ohne invasives Wachstum. Dysplasien werden graduiert in gering, mittel oder schwer, wobei geringer und mittlerer Dysplasiegrad als low-grade dysplasia zusammengefaßt und der schweren Dysplasie als high-grade dysplasia gegenübergestellt werden. Das Entartungsrisiko steigt direkt mit dem Dysplasiegrad an.
Molekulargenetische Grundlagen der Dysplasie-Karzinom-Sequenz: die Aktivierung von Onkogenen (v.a. APC-Gen-, K-ras-Mutation) und Inaktivierung von Tumorsuppressorgenen (= sog. Anti-Onkogenen; v.a. Deletion des DCC-Gens und Mutation und Deletion von p53 mit Überexpression des mutierten p53-Proteins) führen in einem lang dauernden Vielstufenprozeß über Jahre und Jahrzehnte (ca. 10-30 Jahre Latenzzeit) zur Entwicklung einer kolorektalen, epithelialen Neoplasie. Diesem vielstufigen, langdauernden Prozeß genetischer Fehlregulationen kann eine genetische Instabilität aufgrund von Mutationen von DNA-Repair-Genen zugrundeliegen, wie dies für die Mehrzahl der Kolonkarzinome im Rahmen des HNPCC (Lynch-Syndrome) bereits nachgewiesen werden konnte. Die molekulargenetischen Veränderungen werden dabei begleitet von den in der konventionellen Histologie seit langem bekannten, ebenfalls stufenweisen histomorphologischen Veränderungen, die von der normalen Schleimhaut über die Dysplasie mit zunehmendem Dysplasiegrad zum kolorektalen Karzinom führen. Das moderne molekulargenetische Modell der formalen Pathogenese kolorektaler Karzinome untermauert somit eindrucksvoll das effizient diagnostisch anwendbare histomorphologische Konzept der Dysplasie-Karzinom-Sequenz.
Adenome
- solitär
- multiple (meist weniger als 50, auf jeden Fall weniger als 100)
- Die Adenome machen ca. 95% der Dysplasien im Kolorektum aus. Man unterscheidet tubuläre, tubulo-villöse und villöse Adenome verschiedener Dysplasiegrade.
Familiäre adenomatöse Polypose (mehr als 100 Adenome)
Colitis ulcerosa mit Dysplasie
Juvenile Polypose mit Dysplasie
Sonstige
Zusammenfassung
Die pathologische Klassifikation von Kolorektalkarzinomen ist sowohl für die Primärdiagnose und Wahl des Therapieverfahrens als auch für die Prognosebeurteilung wesentlich. Darüber hinaus spielt die pathologische Tumorklassifikation eine entscheidende Rolle bei der Wahl adjuvanter Tumortherapieverfahren (v. a. Chemotherapie). Dabei ermöglicht die Residualtumorklassifikation der UICC die Unterscheidung von potentiell kurativen (R 0-) und primär palliativen (R 1-, R 2-Resektionen) Eingriffen. Das Tumorstaging der UICC mit den Tumorstadien 0-IV ist für eine differenzierte Prognosebeurteilung wesentlich, vor allem innerhalb der Gruppe der R 0-resezierten Patienten. Nach dem histopathologischen Tumortyping sind die kolorektalen Karzinome zu ca. 85% Adenokarzinome, zu ca. 10% muzinöse Adenokarzinome. Der Rest entfällt auf die relativ seltenen, aber hoch agressiven Siegelringzellkarzinome und undifferenzierte Karzinome. Das histopathologische Tumorgrading ist von wesentlicher praktischer Bedeutung bei lokalen Tumortherapieverfahren (endoskopische Polypektomie, chirurgische Lokalexzision), da nur die niedrig-malignen Tumoren (hoch und mittel differenzierte Adenokarzinome) für diese Behandlungsverfahren geeignet sind. Hoch maligne Tumoren (vor allem niedrig differenzierte Adenokarzinome) sind aufgrund statistisch signifikant erhöhter Lymphknotenmetastasierungsraten für lokale Therapieverfahren aus onkologischer Sicht nicht geeignet.
